关于我们
阅读次数: 发布日期:2021-04-14
一、北京大学受试者保护体系的成立背景
进入世界一流大学的行列,除了高水平的医学教育,还需要一流的医学研究。一流的医学研究,不仅意味着对科学与创新的追求,同时也意味着对研究对象以及全人类权益的最好保护。规范的伦理审查和严格、高效的科研管理对我国当前和今后医学研究的健康发展至关重要。但我国在科研诚信、生物医学科研伦理和管理、利益冲突管理等方面,无论是认识还是实践,仍然有较大的空间有待改善。随着我国对创新药物研发的重视和加强,以及生物制品和药品研发的全球化进程的加快,科研伦理审查能力的欠缺和对伦理审查委员会的管理薄弱等现状等,已经成为我国医学研究创新与发展的一个瓶颈。一方面,对我国参与临床研究的广大受试者的安全和权益不能得到真正的保护令人担忧,另一方面也使我们很多有创新性的科研工作无法获得国际认可,学术成果无法在国际较高水平杂志上得以发表,甚至使我们在很多情况下痛失参与国际临床研究的机会。在全球化的医学研究浪潮席卷下,如何应对来自生物医学研究伦理和管理方面的挑战,以切实保护我国受试者的合法权益为根本,以促进医疗保健和公共卫生取得实质性进步为出发点,通过不断提高生物医学研究质量来持续提升我们的国际学术地位,是我校,也是我国,目前亟需解决的问题。
1998年,北京大学提出了“创建世界一流大学”的发展战略,得到了党中央国务院的高度赞扬和大力支持。与北京大学合校后,医学部大力推进了医学与理学、人文和社会学的交叉,加强了学科建设,进一步优化了学科布局,促进了基础医学与临床医学、医学和药学、预防和治疗的结合,形成了若干个新兴的交叉学科群,建立和完善了一批科研和技术平台。特别是北京大学临床研究所的建立和“北京大学临床研究项目”的成立,将提升我校科研能力和激励科研创新。这些基础条件的改善,推动了北京大学医学部的各项科研工作。
北京大学医学部集教学、科研、医疗服务为一体,设有6个学院和8家附属医院。每年除了繁重的教学和医疗服务外,还承担了大量医学研究任务。近五年来,我校承担越来越多的国家科技重大专项、973计划、863计划、科技支撑计划、国家自然科学基金、卫生部临床重点学科、卫生行业科研专项、北京市自然科学基金、首都医学发展基金等纵向科技项目和横向合作科技项目。在研究种类上,除了承担国家“重大新药创制项目”,以及诸多的新药临床试验和多种临床研究外,我校还开展人群流行病学研究、护理研究以及心理行为科学的研究等。随着经费投入渠道的多样化以及转化医学的飞速发展, 以人为对象的研究项目数量得到快速增长,对伦理审查质量的重视程度也日益提高,并对此提出了具体的要求。如何确保我校的生物医学研究符合相关的伦理要求,同时切实保护受试者的权益,是目前我们面临的重要挑战和任务。我们期待高水平、国际化的临床创新研究日益增多的同时,认识到规范医学研究伦理审查,使之达到国际标准已迫在眉睫。医学部作为北京大学的重要组成部分,作为我国医学领域的著名学府,应承担此社会责任,引领我国的医学研究伦理审查制度建设和能力建设,探索符合中国特点的受试者保护体系。
受试者保护,是一个系统工程。无论是研究者个人或团队,或是伦理审查委员会单个组织,都难以独立完成此艰巨任务。受试者保护体系(Human Research Protection Program,缩写为HRPP),是目前国际知名生物医学科研机构在加强医学研究管理和促进受试者保护方面通用的有效工作模式,也是一个医学科研机构是否堪称世界一流的一个具体体现。为此,北京大学于2010年6月正式批准成立北京大学受试者保护工作体系,简称PU HRPP,分设领导小组和工作小组,本着人文、科学、规范、高效的宗旨,开始了全方位探索。为进一步推进体系建设和运行达到国际公认标准,持续提升北京大学生物医学研究伦理和科研管理水平,经2014年7月7日医学部第18次部务办公会研究,决定调整北京大学受试者保护工作体系领导小组和工作小组组成人员,以使此工作更上一个台阶。
二、北京大学受试者保护体系的宗旨
受试者是科研的重要组成部分,他们不仅是被动承担研究的载体,也是创新和互动式的研究中的合作者。人文、人道地对待受试者,是基本的科研伦理要求,只有保证医学研究按照符合伦理规范的轨道健康发展,才能实现它的真正社会价值。我们注重在研究中追求科学、不断创新,更加注重在研究中对受试者的尊重与保护,而且强调对研究的行为负责,注重科研诚信。包括中华民族在内的全人类的健康维护,需要符合伦理的高水平医学研究。对此,我们责无旁贷。
北京大学受试者保护体系将通过为研究者提供高质量和多渠道的培训,对研究方案进行独立、及时和高效的伦理审查,对研究过程进行质量控制,对未来研究者领导力的培养和维护科研的诚信等,全方位地对受试者的权益进行保护。
三、北京大学受试者保护体系组织框架
本着借助已有的机构和整合现有资源的原则,北京大学成立了由7个要素组成的受试者保护体系(见结构图)。具体包括:生物医学伦理审查委员会、质量保证办公室、教育培训中心、技术转移办公室、生物安全委员会、学术委员会和科研诚信办公室。
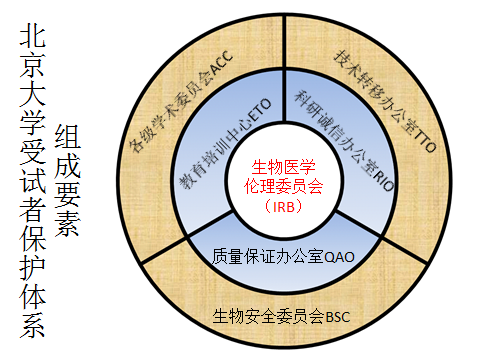
四、北京大学受试者保护体系各构成要素的职能简介
1、生物医学伦理审查委员会(IRB)
伦理审查委员会由专职工作人员和兼职委员组成,负责对涉及人体受试者的生物医学研究进行伦理审查和研究实施中的持续审查, 以保障受试者的权益。
伦理委员会的组建将保证委员会人员组成符合国际规范,委员能胜任审查工作,对研究项目进行独立、高效的审查。在审查工作中,严格遵循标准操作规程开展各项伦理审查工作。聘请独立顾问就审查工作中遇到的特殊、重大问题,提供咨询和建议;秘书处负责日常事务的管理、沟通和协调工作,处理受试者的抱怨、投诉和反馈等,同时为研究者和受试者提供咨询服务。
2、质量保证办公室(QAO)
此办公室肩负对研究过程的监督,以确保研究者严格遵循方案和相关法规开展研究。研究过程的监督管理,包括了解研究进展、核实数据的真实可靠、确认对受试者权益的保护情况,必要时可实地观察知情同意的过程。办公室将根据研究项目的风险高低,以抽查的方式进行日常监查,也可应伦理审查委员会的要求,负责对某项研究实施有因监查,包括对发生的严重不良事件或违背方案进行实地调查,对事件进行评估,给出整改建议和处理意见。
3、教育培训中心(ETO)
此中心主要依托临床研究所的教育培训部来完成教育和培训职能,同时对国际规范、地区规范和政策等进行学术研究,为国际高端的合作提供学术支持。其主要职能体现在对伦理审查委员会委员和研究者提供培训,以及对培训效果进行评估。培训的方式包括网络培训、面授培训和会议研讨等方式。
4、技术转移办公室(TTO)
技术转移办公室具有保护学校的知识产权、管理科技开发项目和合同、孵化科技成果、推动校企合作等一系列综合职能。与资助方合作的涉及人的研究,在合同流转和签署方面,已考虑到对受试者的保护,并纳入工作流程中。
5、生物安全委员会(BSC)
此委员会主要对研究项目中涉及的诸如射线安全、基因重组、实验室泄漏等与人和环境的生物安全问题予以把关;也涉及动物实验和动物安全的管理。
6、学术委员会(ACC)
此委员会主要对研究方案中涉及的选题、试验设计、研究方法的选择等方面的科学性负责,为伦理审查提供科学性方面的保障。我校有院校两级学术委员会,伦理审查中遇到难以把握的科学问题,将会提交此委员会寻求帮助。
7、科研诚信办公室(RIO)
此办公室正在建设中。它关注生物医学研究中(无论是临床还是基础阶段)的科研诚信和利益冲突等相关问题,以处理好我校生物医学研究和实践领域的利益冲突问题,并逐渐杜绝我校科研人员在“Fabrication(造假)、Falsification(篡改)和Plagiarism(抄袭)”三种不端行为。此办公室旨在对这两大领域的问题进行规范和管理,增加国际信任度,提高研究者的诚信意识,从根本上保障我校的科研荣誉。


