郑瑞茂团队发现帕金森病相关新机理
阅读次数: 发布日期:2021-05-06
2021年3月24日,北京大学基础医学院郑瑞茂研究员团队在 Cell Death and Differentiation 在线发表了题为The DJ1-Nrf2-STING axis mediates the neuroprotective effects of Withaferin A in Parkinson’s disease的研究论文,报道一种有帕金森病治疗潜力的天然药物化合物的抗帕金森药理作用机制,并提出一种帕金森发病新机理。

帕金森病(Parkinson’s disease,PD)是一种常见的神经系统退行性疾病,老年人多发。我国65岁以上人群PD的患病率大约是1.7%。近年来,帕金森发病率呈明显升高趋势。值得注意的是,大部分帕金森病患者为散发病例,仅有不到10%的患者有家族遗传史。帕金森病最主要的病理改变是中脑黑质(substantia nigra)区域的多巴胺能神经元退变死亡,由此导致脑运动控制中枢“纹状体”(striatum)的多巴胺含量减少,并由此引发纹状体运动调控功能障碍,其临床表现主要为静止性震颤、运动迟缓、肌强直和姿势步态障碍等。目前认为,帕金森病发病与环境因素、氧化应激、遗传因素、老龄化、蛋白质稳态失衡、及代谢稳态失衡等多因素相关;由于其致病机理仍不清楚,因此缺乏对因治疗的有效药物。
中脑黑质多巴胺能神经元线粒体氧化应激、及神经炎症引起的细胞凋亡,被认为是帕金森发病的重要分子机理。Withaferin A是一种天然药物化合物,具有显著的抗氧化及抗炎等功能。该研究团队发现,对于传统帕金森模型小鼠(MPTP)及人源化帕金森模型小鼠(AAV-human-αsyn),该化合物可支持这些小鼠中脑黑质神经元合成多巴胺的能力,减缓这些神经元的帕金森样损伤。更进一步,该团队采取转录组测序及生物信息技术,分析获得了出该化合物作用下小鼠黑质区域神经细胞的显著变化基因。再有,结合人类帕金森病患者黑质转录组测序数据库及荟萃分析方法,研究人员得出了人类帕金森患者黑质区域神经细胞显著变化的基因。再进一步,研究人员将人类与小鼠的帕金森相关基因进行比较分析,再利用一系列基因工程小鼠及相关实验,确定了该化合物抗帕金森作用的主要分子靶点为DJ-1,NRF2及STING。DJ-1为与帕金森发病相关基因;NRF2为抗氧化关键因子;STING为免疫相关分子,其可被碎裂的内源或外源DNA激活并引发神经炎症。随后,研究人员又将目前临床应用的抗帕金森药物,如金刚烷胺等与Withaferin A进行转录组测序及生信分析研究;其结果显示,对于黑质区域的神经细胞,这些药物可能通过其显著的抗氧化及抗神经炎症作用缓解多巴胺神经元凋亡。这一人类导向的研究,也为抗帕金森药物研发提供了新的可参考信息。
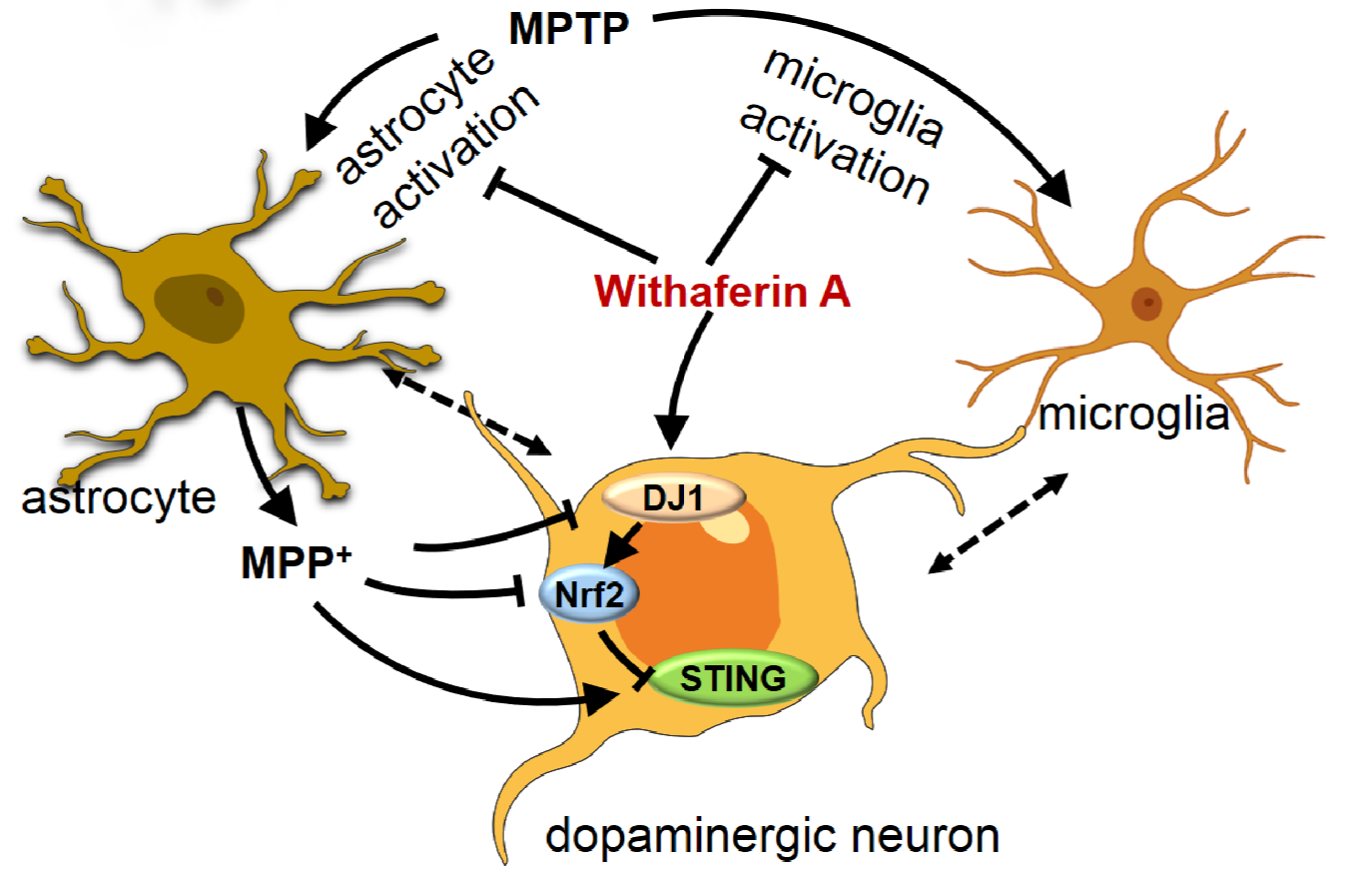
DJ1-NRF2-STING信号通路介导Withaferin A的抗帕金森作用
此外,该研究亦提出一个帕金森发病的新理论,即:外源性或内源性碎裂DNA激活STING系统引发的神经炎症可能是导致多巴胺神经元凋亡、进而引发帕金森病的潜在因素。研究团队指出:病毒感染、损伤的线粒体均可释放出碎裂的DNA片段而激活STING引发神经炎症从而引起黑质多巴胺神经元凋亡,并可能由此导致帕金森发病。这是该团队提出的一个新的帕金森发病机理。研究团队进一步指出:金刚烷胺(amantadine),是一种常用的抗病毒药物,但也用于帕金森病的临床治疗,尽管其抗帕金森病的机理一直不清楚;而金刚烷胺抗帕金森的机理很可能是通过作用于STING以减缓神经炎症诱发的细胞凋亡。
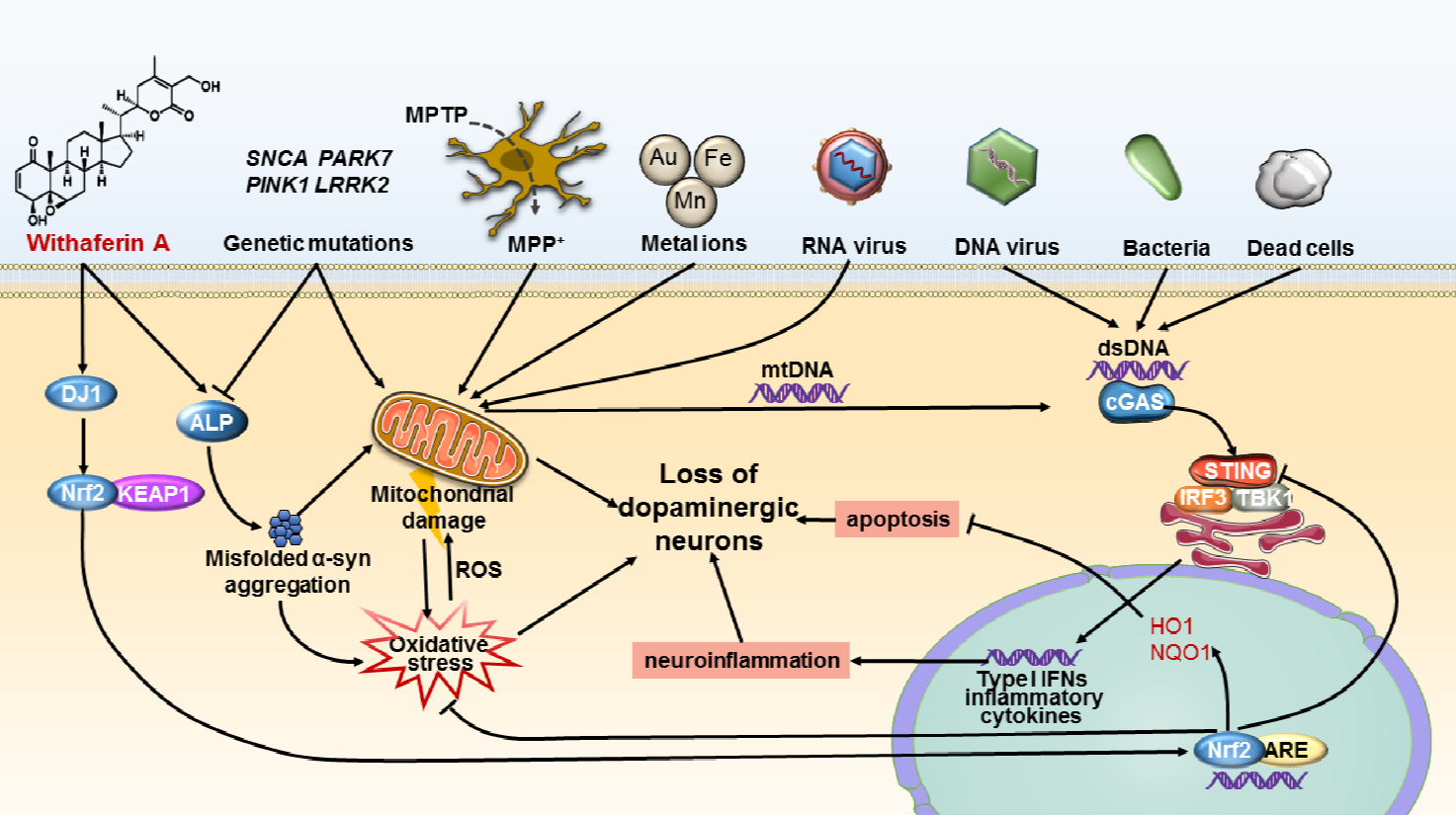
STING介导神经炎症诱发的细胞凋亡可能是帕金森发病新机理
北京大学基础医学院赵淼博士生为该论文第一作者,郑瑞茂研究员为通讯作者。该研究是在人体解剖与组织胚胎学系、北京大学神经科学研究所、教育部神经科学重点实验室、及国家卫生健康委员会神经科学重点实验室平台上完成的一项研究,同时也得到国家重点研发计划和国家自然科学基金的支持。
原文链接:https://www.nature.com/articles/s41418-021-00767-2
(基础医学院)


