马明团队在天然药用功能分子生物合成领域取得重要突破
阅读次数: 发布日期:2021-09-28
近日,北京大学药学院、天然药物及仿生药物国家重点实验室马明研究员团队连续在美国化学会ACS Catalysis学术期刊、英国皇家化学会Chemical Science上发表科研论文,报道其研究团队在天然药用功能分子的生物合成领域取得的系列成果。
1、环肽分子生物合成-发现第一个催化异构化/环化双功能硫酯酶并解析其晶体结构
2021年9月7日,马明研究团队在美国化学会ACS Catalysis上发表了题为“Functional characterization and crystal structure of the bifunctional thioesterase catalyzing epimerization and cyclization in skyllamycin biosynthesis”的研究论文。该研究发现了环肽分子生物合成中第一个催化异构化和环化的双功能硫酯酶,解析其晶体结构并阐明了其活性位点关键残基。
D构型氨基酸不是蛋白质的组成成分,但在天然肽类小分子中却是重要的结构单元。尤其在非核糖体肽类天然产物中,D构型氨基酸是其生物合成中的特征原料砌块(building block)。D构型氨基酸的存在不仅可以提供对蛋白酶水解的抗性、提供生物合成时序控制所需的立体结构限制,而且有的对化合物的生物活性至关重要。自然界已经进化出几种酶来在肽类分子中引入D构型氨基酸。而与这些已知的酶不同,马明研究团队发现了一个催化异构化和环化双功能的硫酯酶Skyxy-TE,该酶能产生含有D构型氨基酸残基的环肽分子。研究团队首先从一株海洋链霉菌Streptomyces sp. PKU-MA01239(来自于课题组构建的海洋细菌菌种库)中发现了非核糖体肽skyllamycin B,该类化合物为含有11个氨基酸残基的环肽分子,具有血小板生长因子抑制活性和抗生物膜活性。Skyllamycin B中含有1个D构型羟基取代亮氨酸,推测其来自于非核糖体肽合成酶(NRPS)装配线最后一个硫酯酶功能域Skyxy-TE的催化。体外酶催化表明Skyxy-TE可以将链状底物类似物(来自于固相多肽合成)C末端L-亮氨酸残基异构化为D-亮氨酸,继而催化分子内环化反应形成环肽产物。有意思的是如果把底物类似物C末端的L-亮氨酸换成L-丙氨酸(侧链只含有一个甲基),Skyxy-TE仍然可以催化L-丙氨酸的异构化产生含有D-丙氨酸的环化产物。
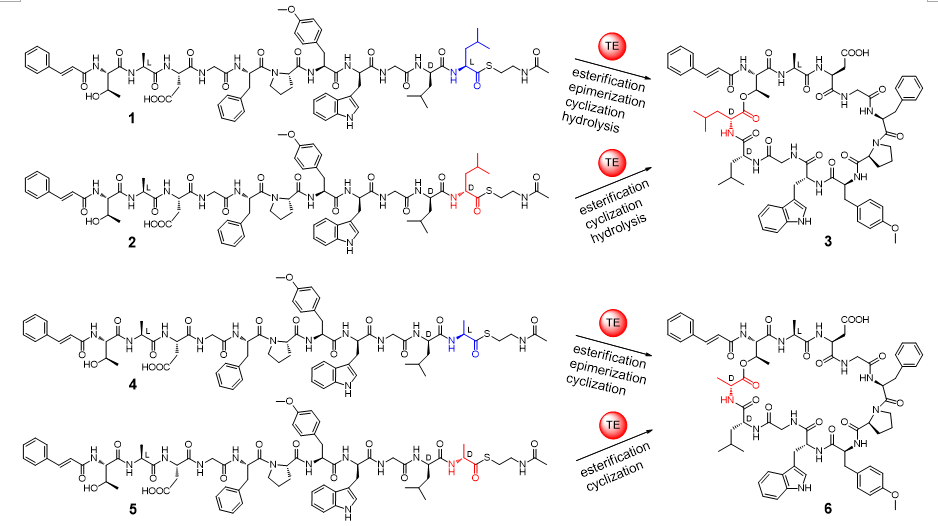
图1. 硫酯酶Skyxy-TE催化的异构化/环化反应
研究团队进而解析了Skyxy-TE的2.25埃分辨率的晶体结构,发现Skyxy-TE具有特异的活性中心,其活性中心由于两个残基(Q125和F202)的存在,使其比目前已知7个NRPS硫酯酶(I型)结构具有更狭窄的活性位点。点突变及体外酶催化表明Skyxy-TE-Q125A突变体失去了异构化的立体选择性,产生了没有异构化的含有L-亮氨酸残基的环化产物;而Skyxy-TE-F202A突变体则基本丧失了环化功能,产生了水解链状产物。本研究对Skyxy-TE异构化/环化的功能表征进一步扩展了目前对非核糖体肽合成酶(NRPS)“多才多艺”的认识,同时本研究对Skyxy-TE晶体结构和关键残基的阐释有利于该酶在化学-酶联催化方面的应用,以进行D或L构型控制的多种环肽分子的制备。
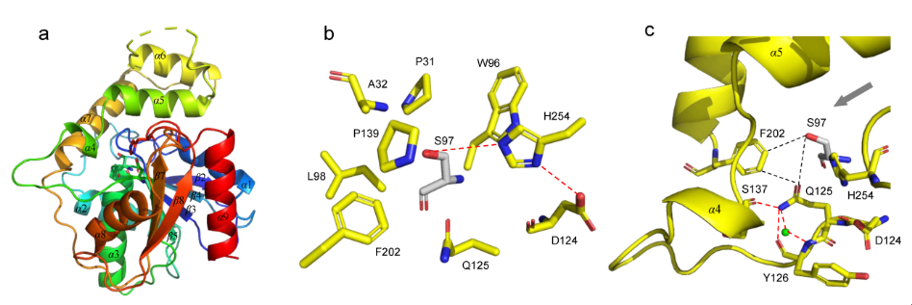
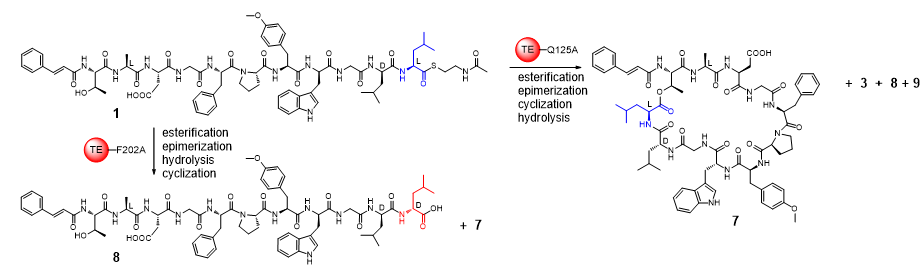
图2. 硫酯酶Skyxy-TE的晶体结构、活性位点以及突变体催化的反应
该项工作得到科技部重点研发计划“深海关键技术与装备”项目“重要深海药源天然产物合成生物学产生体系构建”、国家自然科学基金委项目资助。北京大学药学院博士后于佳慧、博士生宋娟为本论文共同第一作者,北京大学药学院马明研究员为通讯作者。
原文链接:https://doi.org/10.1021/acscatal.1c03064
2、利用生物合成和化学修饰制备新颖套索肽类天然产物
2021年8月10日,马明研究团队在英国皇家化学会Chemical Science在线发表了题为“Rational Generation of Lasso Peptides Based on Biosynthetic Gene Mutations and Site-Selective Chemical Modifications”的研究论文,报道了一类独特的套索肽天然产物的发现,以及利用生物合成基因突变和位点选择性化学修饰制备套索肽衍生物的研究成果。
套索肽(lasso peptides)是一类结构独特的天然产物,结构中常含有14-33个氨基酸残基,其N端第1个氨基酸与第7,8或者第9个氨基酸侧链形成大酰胺环,而C端的氨基酸穿过此大酰胺环,形成标志性的“套索”结构。此“套索”结构具有极强的热稳定性和蛋白酶解稳定性,因此套索肽被认为是具有理想药代动力学性质的潜在药用分子。根据是否含有二硫键以及二硫键的连接位置,目前已经发现四类套索肽。然而,目前套索肽相关研究受到了几个方面的限制:由于独特的三维“套索”结构难以化学合成,导致无法像其它肽类化合物那样用多肽固相合成方法制备化合物库;套索肽生物合成基因簇常处于沉默状态,限制了天然套索肽分子的大量发现;另外,虽然有针对套索肽生物合成基因簇异源表达(主要在E. coli中)的研究报道,但此类研究大多数产生的套索肽产量低,无法满足结构修饰和生物活性测试的要求。
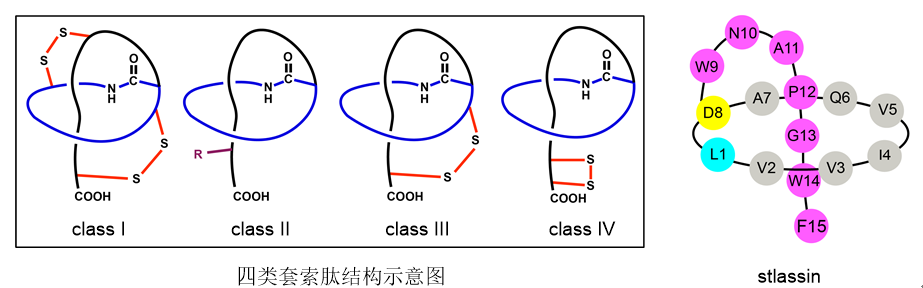
图1. 套索肽的四类结构示意图和本研究发现的新颖套索肽stlassin结构
针对上述问题,马明研究团队首先从一株海洋链霉菌(来自于课题组所构建的海洋细菌菌种库)中发现了一个套索肽生物合成基因簇stla,通过将stla克隆至链霉菌Streptomyces coelicolor A3(2)中进行异源表达,并引入KasOp*启动子激活该基因簇,成功发现一个新颖的II型套索肽stlassin,计算产量可达20 mg/L。基于该异源制备平台,研究团队对stlassin生物合成中前体肽中的核心肽(15个氨基酸残基)开展了点突变,发现核心肽中15个氨基酸位置的突变对生物合成具有不同的影响;同时得益于异源制备平台的高产量以及生物合成中翻译后修饰酶对前体肽突变的容忍性,制备了17个相应的stlassin突变体分子。对stlassin及其变体分子进行了溶液核磁共振结构测定,确证了它们独特的右手螺旋“套索”结构。同时stlassin及其变体分子显示了极高的稳定性,实验证实它们可以对抗95℃加热以及carboxypeptidase Y的酶解。
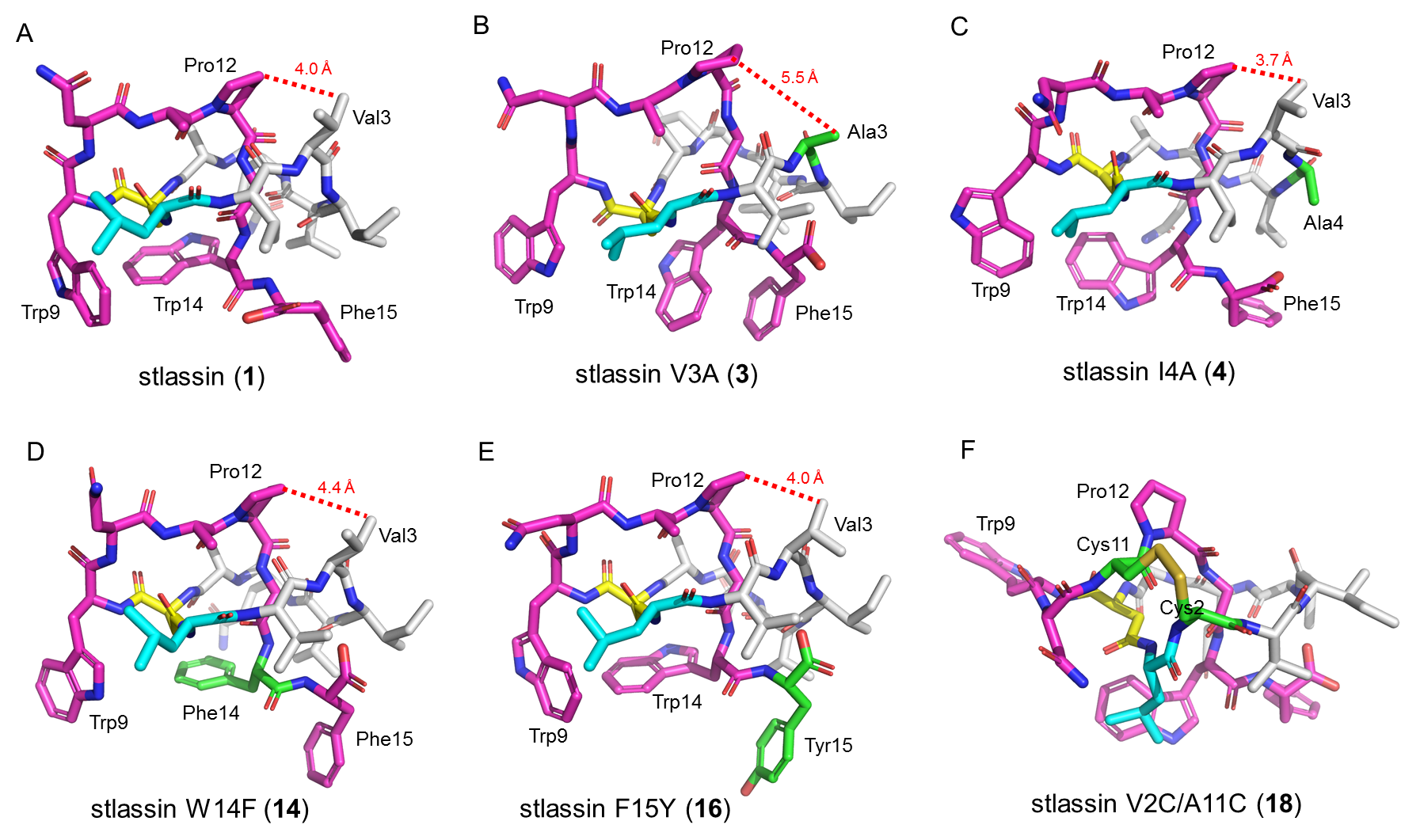
图2. Stlassin及其变体分子的溶液核磁共振三维结构
除了利用生物合成前体肽基因突变获得stlassin变体分子外,研究团队还结合近年报道的蛋白/多肽位点选择性修饰反应,进一步扩展stlassin类分子结构多样性,制备了10个包含O-糖基化、S-糖基化、S-芳香化、分子内二硫键、分子间二硫键、硫消除及巯基分子加成等修饰的stlassin变体分子。部分变体分子结构已经超越了目前对套索肽的四种分类范围。值得注意的是这些修饰反应弥补了生物合成中相应修饰基因缺失的不足,将生物合成制备“套索”骨架与骨架的化学修饰相结合,体现了“源于自然,优于自然”的天然产物变体分子制备理念。研究团队最后对所得stlassin及其变体分子开展了生物活性测试,发现它们不同程度的抑制脂多糖(LPS)与Toll-like receptor 4 (TLR4)受体的结合,表现出抗炎活性的潜力。
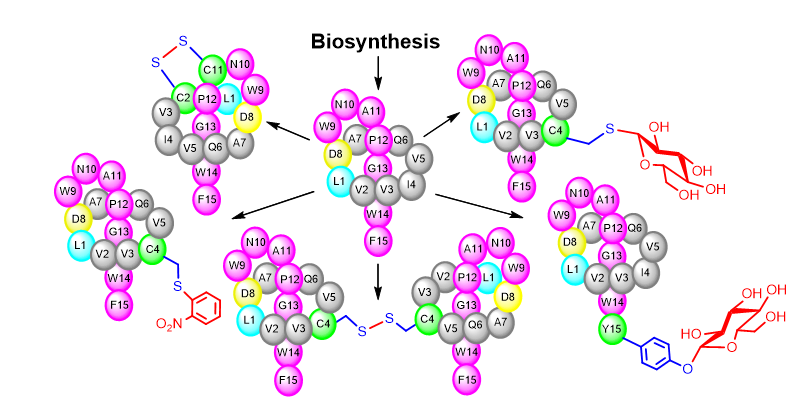
图3. 结合生物合成和化学修饰扩展套索肽结构多样性
该项工作得到科技部重点研发计划“深海关键技术与装备”项目“重要深海药源天然产物合成生物学产生体系构建”、国家自然科学基金委项目资助。北京大学药学院博士研究生刘谈、马晓杰为本论文共同第一作者,中国科学院生物物理研究所蛋白质核磁研究平台的刘雪辉老师和北京大学药学院马明研究员为共同通讯作者。
原文链接:https://doi.org/10.1039/D1SC02695J
【延伸阅读】
马明,北京大学药学院、天然药物及仿生药物国家重点实验室研究员,博士生导师,Tenure-Track助理教授。研究领域为天然药用功能分子的生物合成,酶的三维结构及其催化机制,以及天然产物合成生物学。近5年以通讯作者身份在JACS、ACS Catal.、Chem. Sci.、Commun. Chem.、Org. Lett.、J. Biol. Chem.、J. Org. Chem.、J. Nat. Prod.、Chin. J. Chem.、Appl. Microbiol. Biotechnol.、ACS Omega、Mar. Drug等国际学术期刊发表论文10余篇,任中国药学会海洋药物专业委员会委员、中华中医药学会青年委员会委员、北京药学会天然药物专业委员会委员。
(北京大学药学院 天然药物及仿生药物国家重点实验室)


