姜长涛团队发现宿主肠缺氧诱导因子HIF-2α通过肠道菌群 抑制脂肪产热的新机制
阅读次数: 发布日期:2021-08-02
2021年7月29日,北京大学医学部基础医学院生理学与病理生理学系、北京大学第三医院医学创新研究院基础医学研究中心姜长涛教授团队在Cell Metabolism杂志发表题为“Intestinal hypoxia-inducible factor 2α regulates lactate levels to shape the gut microbiome and alter thermogenesis” 的研究论文,揭示了肠缺氧诱导因子HIF-2α通过乳酸影响普通拟杆菌/扭链瘤胃球菌—胆汁酸—脂肪TGR5信号通路抑制白色脂肪产热的新机制,为肥胖及相关代谢性疾病的防治提供了菌源新靶点及干预新策略。
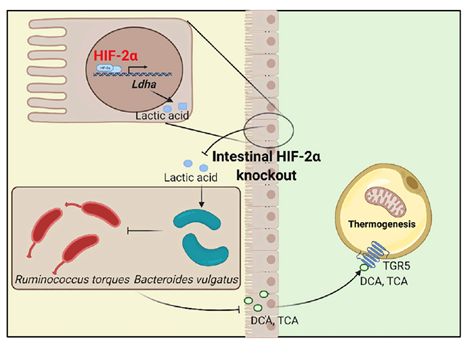
肠道菌群通过多种信号影响宿主代谢,然而宿主如何调控肠道菌群功能一直鲜为人知。姜长涛教授团队发现特异性敲除肠缺氧诱导因子HIF-2α可以明显改善高脂饮食诱导的肥胖及相关代谢紊乱,这种改善作用主要依赖于肠道普通拟杆菌(Bacteroides vulgatus)的减少以及扭链瘤胃球菌(Ruminococcus torques)的增加。运用菌株功能筛选、高效液相色谱、核磁共振等多种技术,发现肠HIF-2α通过产生乳酸诱导普通拟杆菌σ因子表达,增加其利用多糖的能力,进而促进其生长;而普通拟杆菌同时可以直接抑制扭链瘤胃球菌的生长。机制研究表明,宿主乳酸合成的关键基因乳酸脱氢酶Ldha是肠HIF-2α的新型靶基因,肠HIF-2α通过直接激活Ldha增加肠道乳酸含量,影响肠道菌群的组成。进一步利用功能代谢组学技术发现肠HIF-2α特异性敲除小鼠的胆汁酸谱发生改变,其中牛磺胆酸(TCA)及脱氧胆酸(DCA)的水平显著增加。胆汁酸TCA与DCA激活脂肪TGR5受体,进而通过UCP1依赖的质子漏以及CKMT2介导的肌酸无效循环两种途径促进白色脂肪产热,进而改善肥胖。
该研究为解析宿主基因—肠道菌群—宿主代谢交互调控的机制提供了新的理论依据,同时为预防和治疗肥胖及相关代谢性疾病提供了新的干预策略。北京大学医学部基础医学院、北京大学第三医院医学创新研究院姜长涛教授为该文章的通讯作者,博士生吴勍、梁贤毅及博士后汪锴为共同第一作者。该研究得到了国家自然科学基金(91857115)、国家重点研发计划(2018YFA0800700)等基金的资助。
原文链接:https://www.sciencedirect.com/science/article/abs/pii/S1550413121003235
(基础医学院)


