王晶团队利用APEX2邻近标记铜伴侣蛋白Atox1鉴定细胞核铜结合蛋白CRIP2调节自噬
阅读次数: 发布日期:2021-09-26
近日,北京大学药学院王晶团队在学术期刊Angewandte Chemie International Edition发表了题为“APEX2-based Proximity Labeling of Atox1 Identifies CRIP2 as a Nuclear Copper-binding Protein that Regulates Autophagy Activation”的研究论文,报道了该研究团队利用APEX2邻近标记技术鉴定铜伴侣蛋白Atox1细胞核内铜结合蛋白CRIP2从而调节自噬的研究工作。
铜(Cu)是从电子转移到催化再到结构作用等多种生物过程中必不可少的细胞成分。铜浓度异常与包括癌症在内的各种病理疾病有关。由于体内大多数铜离子都与蛋白质结合,因此探索铜转运蛋白的机制和调控机制可能有助于开发新方法,以解决涉及铜转运蛋白和铜代谢失衡的靶标疾病。根据生物信息学方法鉴定出的铜结合蛋白列表仍少于整个蛋白质组的0.5%。因此,细胞内铜结合蛋白的发现及其在不同亚细胞区室中功能的研究仍然是巨大的挑战。
由于游离铜离子具有剧毒作用,因此铜的含量受到一系列转运蛋白,分子伴侣和酶的严格调控。铜一旦进入细胞,就会被胞质铜伴侣蛋白(例如ATOX1,CCS和COX17)束缚并运输,从而被运送到特定的细胞目的地。越来越多的证据证实,铜是细胞核中存在的主要金属离子,但铜在细胞核内的作用尚不清楚。一些报道证明Atox1通过转运铜离子到细胞核来调节细胞增殖所需基因的表达,但是铜在细胞核中的稳态机制对肿瘤的发生在很大程度上仍然不确定。由于Atox1与其下游铜蛋白之间的相互作用是瞬时、微弱的,因此免疫共沉淀和酵母双杂等传统手段难以研究其相互作用。近年来兴起的抗环血酸过氧化物酶(APEX2)标记技术能在活细胞水平研究瞬时以及弱结合的蛋白-蛋白相互作用。在这项研究中,北京大学药学院王晶团队利用Atox1的核定位和铜传输功能,并将Atox1用作“诱饵”,从而提供了活细胞内具有时空分辨率的铜蛋白互作网络系统视图。随后,通过二甲基标记定量蛋白质组学分析,确定了CRIP2可以作为潜在的铜结合蛋白与Atox1相互作用。
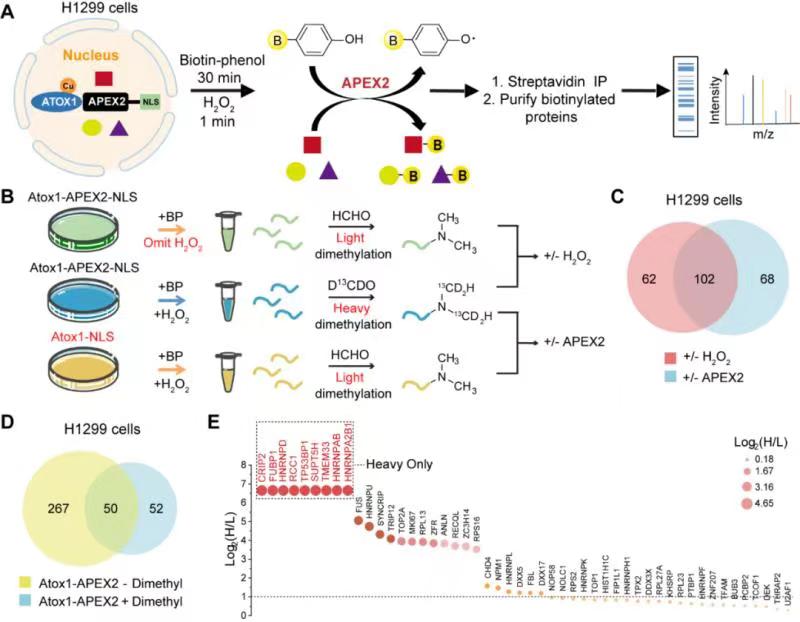
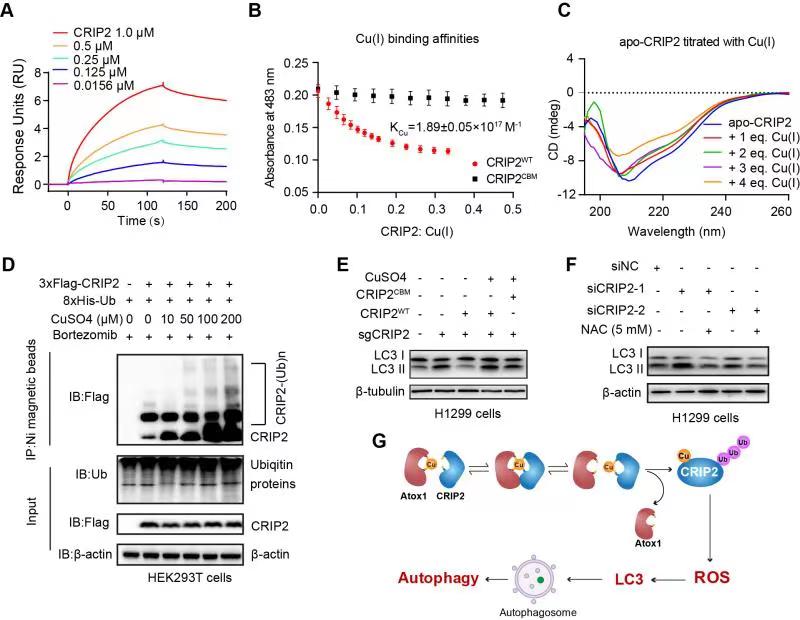
研究表明Atox1可以将铜离子转移至细胞核并传递至CRIP2,从而导致CRIP2蛋白的二级结构发生改变,最终促进其泛素化降解。在H1299细胞中,铜诱导的CRIP2降解可提高细胞内的ROS水平并激活自噬,暗示CRIP2介导的铜代谢在癌细胞自噬激活过程中的作用。上述发现也为肿瘤内铜紊乱的治疗提供新的作用机制和药物筛选靶点。
北京大学药学院王晶研究员为本研究论文的通讯作者。北京大学药学院博士后陈林、李娜和北京大学药学院博士研究生张美琪为论文的共同第一作者。该工作得到科技部重点研发计划和国家自然科学基金委等项目资助。

左起:陈林(博士后),王晶(研究员),张美琪(博士研究生)
原文链接:https:// doi.org/10.1002/anie.202108961
(北京大学药学院)


